|

Introduzione
Sempre più spesso oggi si sente
parlare di inseminazione artificiale nei rapaci, ma
poche persone sanno veramente che cosa essa sia, o
lo immaginano solo vagamente. Altre persone invece
sono convinte di saperne abbastanza, quando invece
ne sanno ben poco. Io, personalmente, mi sono
sforzato negli ultimi anni di acquisire su questo
argomento quante più informazioni possibili, sia
grazie a lunghe chiacchierate con amici allevatori
che la praticano normalmente, sia, soprattutto,
studiando su appositi testi, manuali ed articoli
scientifici. Per i motivi sopraesposti ho pensato di
scrivere questo breve articolo di introduzione alla
tecnica dell’inseminazione artificiale, quanto meno
per illustrarne le maggiori caratteristiche
applicative e fare così in modo che tutti possano
sapere di cosa realmente si tratti. Non è mia
intenzione soffermarmi nel descrivere esattamente le
tecniche per praticarla correttamente, ciò
richiederebbe troppo spazio e soprattutto troppo
tempo ed energia. Chiunque desiderasse avere delle
informazioni più approfondite può leggere lo studio
ben più approfondito che ho preparato contattandomi
(hyerax@gmail.com). L’obiettivo che mi sono prefisso
è invece quello di mostrare tutti gli aspetti
generali relativi all’applicazione di questa tecnica
per capire quali in realtà siano i problemi nel
metterla in pratica ed i veri vantaggi che essa può
dare.
Terminologia
La prima cosa che mi preme trattare
è un po’ la terminologia. In realtà esistono
svariate tecniche diciamo così di “riproduzione
artificiale” e di queste solo una, fondamentalmente,
è quella praticata con i rapaci, oggi. Per prima
cosa dobbiamo tenere presente alcuni fondamenti di
biologia:
A)Un essere vivente deriva da un
embrione, che si sviluppa e si accresce fino a
diventare adulto, anche l’embrione è dunque un
organismo vivente;
B)In qualsiasi organismo esistono
fondamentalmente due tipi di cellule e cioè le
cellule somatiche (che sono diploidi, cioè
contengono una doppia copia di ogni cromosoma) e le
cellule germinali (che sono quelle che servono per
la riproduzione cioè spermatozoi nei maschi e
cellule uovo nelle femmine e sono apolidi cioè
contengono una singola copia per ogni cromosoma)
(ricordo che i cromosomi non sono altro che il DNA
di una cellula aggregato e compattato in una
strutture, i cromosomi, di solito visibili in forma
di X e localizzati nel nucleo della cellula);
C)Un embrione dunque deriva
dall’unione di due gameti, quello maschile, che è lo
spermatozoo (e proviene dalle gonadi maschili che
sono i testicoli) e quello femminile che è la
cellula uovo (e proviene dalle gonadi femminili che
sono le ovaie). Lo spermatozoo feconda l’uovo quando
vi entra dentro. Ecco perché le cellule germinali
sono apolidi, perché quando si uniscono a dare
l’embrione, che è già un organismo vivente, si
otterrà una cellula diploide che si moltiplicherà
miliardi di volte fino a dare l’organismo adulto.
Detto questo viene facile capire che
il seme non è quello che comunemente si pensa e cioè
gli spermatozoi del maschio, ma è, come per le
piante, l’embrione (il seme di una pianta non è
altro che l’embrione della pianta stessa che si è
formato dall’unione del polline con la cellula uovo
del pistillo femminile). Il termine INSEMINAZIONE
ARTIFICIALE dunque significa inserire un embrione
dentro la femmina. E questa non è la tecnica
praticata sui rapaci. L’inseminazione artificiale è
una tecnica molto avanzata che viene attualmente
usata sull’uomo e che prende il nome di FIVET
(Fecondazione in Vitro Embryo Transfer) che
significa: si prende una cellula uovo e si mette in
un vetrino da microscopio, si prendono poi degli
spermatozoi e con una microiniezione vengono
inseriti dentro la cellula uovo, il che praticamente
imita il processo della fecondazione (per questa
viene detta Fecondazione in Vitro o FECONDAZIONE
ARTIFICIALE), quindi quello che otteniamo è un
embrione; poi si prende questo embrione e lo si
inserisce con un apposito strumento dentro l’utero
femminile (ecco perché si parla di Embryo Transfer,
cioè di trasferimento dell’embrione). La tecnica
invece utilizzata per i rapaci e praticamente per
tutti gli uccelli compresi quelli domestici
(pollame, quaglie, fagiani ecc.) è abbastanza
diversa; essa consiste nel prelevare dal maschio gli
spermatozoi e di inserirli artificialmente nella
cloaca femminile dove questi risaliranno l’ovidutto
fino a raggiungere l’ovaio dove andranno a fecondare
le cellule uovo. In questa tecnica dunque l’unica
cosa che c’è di artificiale è la copula cioè non è
il maschio che monta sulla femmina per inserire il
suo sperma della sua cloaca ma siamo noi che lo
facciamo. Non si può allora parlare di inseminazione
artificiale né di fecondazione artificiale ma si
parla di GAMETIZZAZIONE ARTIFICIALE perché appunto è
l’uomo che artificialmente inserisce gli spermatozoi
(che sono i gameti maschili) nella femmina.
Però come avete visto dal titolo
dell’articolo anche io uso il termine di
inseminazione artificiale, ma semplicemente perché
se dicessi gametizzazione artificiale non mi
capirebbe nessuno!
Storia e geografia dell’Inseminazione Artificiale
nei rapaci
Praticamente le tecniche di
gametizzazione artificiale furono applicate già a
partire dagli stessi anni in cui iniziarono a
svilupparsi le tecniche di riproduzione in cattività
dei rapaci. Già nel 1968 si tentò di ottenere sperma
da un maschio di Aquila reale allo scopo di
fecondare una femmina (Hamerstrom, 1968). Ma i primi
incoraggianti risultati, anche perché ottenuti in
serie si ebbero a partire dagli anni ’70 ad opera
dello staff del Peregrine Fund, che perfezionò la
tecnica per i Falchi pellegrini sviluppando delle
apposite metodologie (come ad es. le tecniche
cooperative). Già a partire da questi anni voglio
ricordare i notevoli studi effettuati da David M.
Bird alla Mc Gill University in Canada, su un grosso
ceppo in cattività di Gheppi americani (Falco
sparverius); tali ricerche portarono alla scoperta
di numerosi dati che si
rivelarono fondamentali per la corretta pratica della gametizzazione artificiale
(Bird, 1983, Bird, 1993, Bird and Lague, 1976, Bird, Lague and Buckland, 1975, Bird,
Lague and Buckland, 1976).
Oggi la tecnica della gametizzazione
artificiale viene praticata soprattutto in centri di
riproduzione e zoo allo scopo di gestire
correttamente ceppi in cattività di rapaci per
conservazione genetica e per programmi di
reintroduzione. Ma il più largo uso che se ne fa è
da parte di riproduttori privati di rapaci per
falconeria, anche perché è l’unico metodo veramente
efficace per la produzione di ibridi e per la
riproduzione di specie classicamente “difficili”.
Perchè usarla
La prima cosa che bisognerebbe
chiedersi prima di cimentarsi nelle tecniche di
gametizzazione artificiale, (e che tutti gli
allevatori che le praticano dovrebbero chiedersi) è:
perché usare queste tecniche? Vale la pena usarle?
Hanno qualche vantaggio da renderne utile
l’applicazione?
Queste domande sono il punto di
partenza fondamentale. Ragionando un po’ e basandosi
sulle esperienze che si hanno finora su questa
metodologia si potrebbe rispondere che la
gametizzazione artificiale dovrebbe essere
utilizzata solo qualora si presentasse una di queste
circostanze:
1) Usata, a posteriori, per
ottenere la deposizione di uova fertili da coppie
che non si riproducono spontaneamente. Per esempio
si prova ad ottenere una riproduzione naturale (che
è sempre la migliore) e se non si riesce si gioca la
carta della gametizzazione artificiale. Si pensi
anche a tutti i rapaci irrecuperabili presso i
centri di recupero. Ottenendone una riproduzione,
anche grazie alle tecniche di gametizzazione
artificiale, si potrebbero creare dei ceppi in
cattività A quali scopi? Banca genetica, programmi
di reintroduzione o ripopolamento, studi biologici
ecc.
2) Possibilità di produrre
ibridi con alte percentuali di successo (ovviamente
limitatamente alla compatibilità biologica delle
specie coinvolte)
3) Possibilità di “recuperare”
gli imprintati (sull’uomo) oggi tanto usati per la
falconeria, ma difficilmente riproducibili con
tecniche naturali.
4) Possibilità di controllare
adeguatamente il pool genico di una popolazione in
cattività. Questo è soprattutto utile nei progetti
di riproduzione in cattività a scopo di Banca
genetica e/o di reintroduzione allo stato selvatico.
Come si sa infatti in tali progetti una delle
proprietà immancabili deve essere la corretta
configurazione e gestione genetica degli individui
che compongono il ceppo. Bisogna evitare l’imbreeding,
la deriva genetica, l’out-crossing e soprattutto
mantenere una variabilità genetica tipica di quella
specie. Ma trattandosi di una popolazione in
cattività e dunque ridotta, con le metodiche di
gametizzazione artificiale si può fecondare una
femmina con sperma proveniente da vari maschi e,
viceversa, usare lo sperma di ogni maschio per
fecondare uova di varie femmine. In tal modo si
riesce a diffondere uniformemente tutti i geni a
tutta la popolazione ed alla fine la progenie
ottenuta sarà composta da individui tutti
completamente diversi l’uno dall’altro e che
condividono praticamente tutti i geni del ceppo in
cattività.
5) Usata a priori per ottenere
una “quasi garanzia” di riproduzione in specie
classicamente “difficili” da riprodurre in cattività
(Astori, Aquile ecc.). In tal caso si acquisiranno
gli esemplari con l’obiettivo diretto di riprodurli
con tecniche di gametizzazione artificiale.
6) Possibilità di fecondare
molte uova possibilmente da più femmine con un solo
maschio, con notevole risparmio di soldi (si usa un
solo maschio al posto di due) e di spazio (nello
spazio di 3 rapaci si hanno 2 femmine ed un
maschio). Ovviamente un obiettivo del genere è
raggiungibile solo con la tecnica del prelievo
cooperativa e solo dopo accurata selezione dei
maschi al fine di trovare quello che produce di più
(ricordate che non tutti gli individui sono uguali,
un maschio può produrre più di un altro,
semplicemente per una questione di variabilità
individuale).
7) Possibilità, infine, di
ottenere riproduzione in spazi ambigui sia perché
gli imprintati possono essere alloggiati in voliere
più piccole e sia perché si possono anche tenere sul
blocco gli individui da riprodurre ( ma questo vale
solo per le tecniche di prelievo e gametizzazione
con massaggio).
Da quanto illustrato sopra risulta
che se non si presenta una (o più) di queste
esigenze è inutile praticare la gametizzazione
artificiale, tenendo anche presente che la
riproduzione naturale è sempre la migliore
soluzione, perché i rapaci faranno tutto da soli
senza impegnarci in procedure complesse. Ma se la
riproduzione naturale non è fattibile ci si può
giocare questo asso.
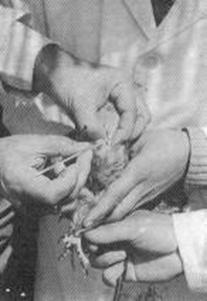
|
Fig. 37:
Procedimento di gametizzazione di una
femmina di Gheppio comune (Falco
tinnunculus). |
Le Tecniche
Fondamentalmente la procedura di
gametizzazione artificiale si divide in due fasi
principali: a) Prelievo dello sperma dal maschio b)
Inserimento di questo sperma nella cloaca femminile
(gametizzazione della femmina).
Per ottenere il prelievo dello
sperma, così come per gametizzare la femmina
esistono varie metodologie, alcune delle quali
simili per maschio e femmina ed altre esclusive, per
cui possono essere anche incrociate tra loro, come
si vedrà dopo.
Una sintesi delle tecniche
utilizzate è illustrata nella tabella che segue:
|
SESSO |
TECNICA |
DESCRIZIONE |
|
MASCHIO |
MASSAGGIO INVOLONTARIO |
Si preleva lo sperma massaggiando
delicatamente l’area circostante la
cloaca. All’inizio ciò avverrà a
prescindere dalla volontà dell’animale
che anzi rifiuterà tale trattamento ma
successivamente si abituerà e
collaborerà con l’operatore |
|
DONAZIONE VOLONTARIA |
Si sfrutta il fenomeno
dell’imprinting artificiale che viene
artificialmente diretto sull’uomo
(allevando a mano i maschi sin da
piccoli). Da adulti questi individui
copuleranno spontaneamente con l’uomo
dando il loro sperma. |
|
ELETTROEIACULAZIONE |
Attraverso una stimolazione
elettrica dell’area attorno alla cloaca
si induce la contrazione dei muscoli e
l’eiaculazione |
|
COTTON-FLOCK |
Tecnica sperimentale che consiste
nell’inserire direttamente nella cloaca
il cottonflock allo scopo di assorbire
lo sperma. |
|
PRELIEVO CHIRURGICO |
Si può praticare solo in casi
estremi o su individui selvatici morti.
Non usata dagli allevatori privati, ma
utile per progetti di riproduzione
avanzata. |
|
FEMMINA |
MASSAGGIO INVOLONTARIO |
Avviene come per i maschi solo che
si fa allo scopo di estroflettere
l’ovidutto dalla cloaca per inserirvi lo
sperma prelevato dal maschio. |
|
GAMETIZZAZIONE VOLONTARIA |
Come per i maschi, ma allo scopo
di gametizzare. |
|
PROCEDURA CHIRURGICA |
Si fa iniettando lo sperma
dall’addome per mezzo di un lungo ago.
Solo per casi eccezionali e solo per
programmi di riproduzione avanzata. |
|
GAMETIZZAZIONE CON COTTON-FLOCK |
Sperimentale. Come per il maschio
ma il cotton-flock inserito
nell’ovidutto è imbevuto dello sperma
assorbito dal maschio. |
|
GAMETIZZAZIONE OVULARE |
Sperimentale. Consiste
nell’iniettare lo sperma direttamente
sulle uova deposte “chiare” cioè non
fecondate. |
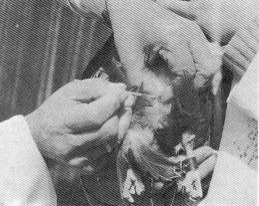
|
Fig. 38:
Procedura di gametizzazione di una
femmina di Astore (Accipiter gentilis) |
TECNICA DEL MASSAGGIO FORZATO
Metodologia
Si pratica massaggiano con appositi
movimenti della mano tutta l’area attorno alla
cloaca allo scopo di rilassare e poi stimolare i
muscoli (ed in particolare la muscolatura dei dotti
deferenti). Valida sia per il prelievo di sperma dai
maschi che per la gametizzazione delle femmine.
Vantaggi
E’ molto buona nel caso di individui
non imprintati e quindi anche di esemplari
traumatizzati e non recuperabili. Richiede meno
tempo e una minore preparazione degli animali
rispetto alla tecnica cooperativa. Permette di
sfruttare appieno le coppie. Acquistando una nuova
coppia, infatti, si sceglieranno individui
potenzialmente idonei ad accoppiarsi naturalmente
(con notevole risparmio di tempo e lavoro) ma si
potrà procedere in qualsiasi momento alla
gametizzazione artificiale se la coppia non vuole
riprodursi spontaneamente.
Svantaggi
Risulta più difficile da praticare
dal punto di vista manuale rispetto alla tecnica
cooperativa. La qualità e la quantità di sperma
ottenuto non sarà mai molto buona proprio perché il
maschio che subisce tale trattamento risulterà
sempre stressato (più o meno). Lo sperma che si
riuscirà a prelevare con questa tecnica infatti
risulterà spesso inquinato da urati, soprattutto e
la loro presenza ne riduce le capacità fecondanti.

|
Fig. 39: Una fase
della tecnica di prelievo di seme con la
tecnica del
massaggio da un maschio di Gheppio
Europeo. |
TECNICA DI PRELIEVO COOPERATIVO
Metodologia
Si usano maschi il cui imprintig
sessuale è sull’uomo (cioè allevati a mano sin da
piccoli). Una volta adulti questi individui
riconoscono nell’uomo un conspecifico e dunque un
potenziale partner per la riproduzione, così i
maschi copuleranno (eiaculando) sul guanto o sul
cappello tenuto dall’allevatore (che saranno
ricoperti da una spugna porosa e sterile dove si va
a raccogliere lo sperma che verrà poi comodamente
raccolto). E le femmine accetteranno la
“copulazione” con la mano da parte dall’uomo,
estroflettendo volontariamente l’ovidutto e rendendo
così più facile le operazioni di gametizzazione. Per
ottenere però un tale risultato è necessario che
l’allevatore corrisponda adeguatamente i
comportamenti corteggiativi sia dei maschi che delle
femmine imprintate e per questo è necessario
conoscere a fondo i patterns corteggiativi della
specie coinvolta. Quindi tale tecnica è valida sia
per prelevare lo sperma dai maschi che per
gametizzare le femmine.
Vantaggi
Facilità nell’ottenimento dei
risultati, poiché sono i rapaci coinvolti (maschio e
femmina) che faranno tutto o quasi da soli, bisogna
solo corrispondere i loro comportamenti e operare
con le giuste tecniche. Buone o ottime quantità e
qualità di sperma ottenuto (poco inquinato).
Svantaggi
Lo svantaggio principale di questa
tecnica è che bisogna passare molto tempo (dico
molto cioè almeno 3-4 ore al giorno per ogni
individuo) sia con i maschi che con le femmine.
Altro svantaggio è che gli animali devono essere
imprintati sull’uomo, ma dipende dai punti di vista:
da un lato è utile, perché tale tecnica
permetterebbe di “recuperare” gli imprintati
permettendo di riprodurli, dall’altro lato, quando
si vuole acquistare una nuova coppia bisogna
scegliere a priori se prendere individui imprintati
o no, cioè bisogna decidere da subito se procedere
direttamente con la gametizzazione artificiale o con
la riproduzione naturale.

|
Fig. 40:
Come avviene la copulazione per il
prelievo cooperativo dello sperma. A
sinistra: figura tratta dal Peregrine
Fund che illustra il particolare
cappello da utilizzare, circondato, come
si vede, da una apposita guaina
ricoperta da spugna a cellule chiuse
dove si raccoglierà lo sperma. A destra:
foto di un giovane maschio di Gheppio
comune, imprintato sull’uomo, durante i
suoi primi tentativi di copulazione con
l’uomo. Ovviamente non riesce ancora ad
eiaculare e la testa non è coperta
dall’apposito cappello. |

|
Fig. 41: Maschio di Gheppio comune
imprintato sull’uomo allo scopo di
utilizzarlo per il prelievo di seme
cooperativo. La foto mostra una fase del
corteggiamento (inchino a capo
abbassato) verso l’allevatore poco prima
della copula volontaria e prelievo del
seme volontariamente. |
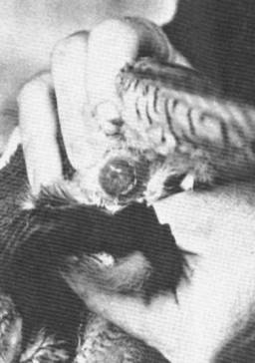
|
Fig. 42:
Estroflessione volontaria dell’ovidutto
di una femmina di Falco pellegrino, al
Peregrine Fund. |
ELETTROEIACULAZIONE
Metodologia
Questa tecnica non è pericolosa come
si potrebbe pensare perché non vengono usati
voltaggi troppo alti (che potrebbero provocare la
morte dell’ uccello per arresto cardiaco) tanto che
gli elettrodi possono essere toccati anche a mani
nude. Questa tecnica è stata usata soprattutto con
gli Psittaciformi (pappagalli) e con i rapaci è
ancora in via di sperimentazione.Vengono usati due
elettrodi, ben lubrificati. Uno ha la forma di un
proiettile calibro 22 ed è posizionato sul coprodeo.
L’altro è posto in buon contatto elettrico con la
pelle nella regione bassa dei reni. Lo scopo è
quello di provocare una leggera stimolazione delle
testi dei dotti deferenti. I dotti dovrebbero
contrarsi in breve tempo eiaculando così il seme.
Ovviamente questa tecnica può essere applicata solo
ai maschi.
Vantaggi
Permette di ottenere sperma con
facilità senza bisogno di apprendere le complesse
tecniche del massaggio ma, allo stesso tempo, senza
dover dedicare tutto quel tempo agli animali (come
per gli imprintati).
Svantaggi
Come detto è ancora una tecnica
sperimentale, sulla quale si sa poco. E prima che
divenga popolare sarà bene studiarla a fondo. La
qualità del sperma, inoltre, di solito, non risulta
quantitativamente elevata come per la tecnica
cooperativa.

|
Fig. 43:
Apparecchiatura per l’elettroeiaculazione
felina, ma adattabile ai rapaci. |
GAMETIZZAZIONE OVULARE
Procedura
Anche questa metodologia è
sperimentale. Secondo quanti la hanno sperimentata
si dovrebbero ottenere il 30% di uova correttamente
fecondate. Consiste nell’iniettare lo sperma
direttamente all’interno delle uova chiare deposte
dalle femmine (per esempio il primo uovo che è
sempre chiaro) in una apposita zona dell’uovo, in
modo da centrare il disco germinale.
Vantaggi
Permette di recuperare le uova
chiare che andrebbero altrimenti perdute. Inoltre si
risparmierà di dover apprendere la tecnica del
massaggio per gametizzare le femmine o di dover
perdere tempo con quelle imprintate.
Svantaggi
E’ una tecnica sperimentale, ma da
quello che si è visto l’unico svantaggio è di
“perdere” inutilmente del sperma(anche se comunque
se ne userà di meno, visto che non c’è pericolo che
esso si disperda nell’ovidutto prima di arrivare
alla cellula uovo) per quel 70% di uova che non
verranno fecondate (perché abbiamo detto che la
percentuale di fecondazione è del 30%). La cosa
migliore, comunque, sarebbe di usarla come tecnica
additiva, oltre alle altre tecniche di
gametizzazione delle femmine.
La Procedura Generale
Comparando tutte le tecniche
descritte troviamo che la tecnica migliore da usare
è quella cooperativa. Ma bisogna tenere conto che
per un processo completo di gametizzazione
artificiale si possono usare due tecniche diverse
cioè, per esempio, ottenere lo sperma con la tecnica
cooperativa e gametizzare le femmine con la tecnica
forzata. Questo perché la tecnica cooperativa, a
parte la facilità, dà il grande vantaggio di potere
ottenere discrete quantità di sperma puro e poco
inquinato, quindi è soprattutto nei maschi il
vantaggio di questa tecnica; solo così si può usare
un solo maschio (razzatore) per coprire e fecondare
le uova di più femmine, con notevole risparmio di
spazio e soldi.
Un altro interessante punto da
affrontare è la diluizione dello sperma. I rapaci
producono delle ridotte quantità di liquido seminale
(sperma) per esempio un Pellegrino produrrà nelle
migliori condizioni 95 μl (microlitri, cioè
milionesimi di litro) di sperma ed un Gheppio
americano ne produrrà 12μl. Queste quantità sono
troppo esigue per cui danno problemi sia perché non
sempre si riuscirà a fecondare un uovo con tali
quantità e sia perché risulta difficile il
maneggiamento dello sperma in così ridotte quantità.
Ecco il motivo per cui lo sperma appena prelevato
deve essere diluito. Inoltre la diluizione è l’unico
metodo che ne permette la conservazione in frigo
fino anche a 75 ore. Per diluire lo sperma si usano
delle soluzioni (“semen extensor”) quali per esempio
la soluzione di Ringer al 50% oppure altre
realizzate con apposite formule come ad esempio:
Cloruro potassico
0,2 g
Cloruro calcico
0,2 g
Cloruro di magnesio
0,1 g
Glucosio
5 g
Citrato sodico
7,7 g
Glutammato monosodico 23 g
Cisteina
0,02 g
Per un litro di acqua distillata
Per quanto riguarda la
conservazione diciamo che lo sperma diluito al 50%
in volume con una soluzione delle suddette e
conservato a 4 C˚ in frigorifero può essere
conservato anche per 3 giorni, ma si deve
considerare che per ogni ora che passa lo sperma
perderà capacità fecondante e la cosa migliore è
allora di usarlo subito, o, comunque appena
possibile. Sono state sperimentate, già a partire
dal 1980, anche le tecniche di congelamento (criopreservazione)
dello sperma dei rapaci, alla stregua degli uccelli
domestici (Brock, M.K. and D.M. Bird. 1991). I
risultati ottenuti inizialmente non superavano il
30% di uova schiuse correttamente dopo
gametizzazione con sperma congelato, ma dagli ultimi
esperimenti effettuati (in cui è stato usato il
DiMetilSolfOssido, DMSO) ho letto che si riesce a
raggiungere anche il 70% di schiudibilità. La
tecnica del congelamento non è difficile di per sé
(oggi in Italia moltissimi centri sarebbero in grado
di congelare efficacemente sperma di rapaci), la
difficoltà consiste nello studiare ed usare la
giusta soluzione per la diluizione dello sperma;
tanto più questa metterà “a loro agio” gli
spermatozoi e tanto maggiore sarà la capacità
fecondante dello sperma dopo congelamento.

|
Fig. 44:
Microcapillare contenente sperma di
Falco pellegrino, appena prelevato e
diluito. |
Le problematiche
Come accennato prima, l’obiettivo
di questo articolo è quello di illustrare gli
aspetti generali e non le tecniche pratiche.
Dicevamo che i passaggi fondamentali
sono il prelievo dello sperma dal maschio da un lato
e l’immissione di questo nell’ovidutto femminile
attraverso la cloaca, dall’altro.
Perché un maschio possa produrre
sperma e dunque affinché ci sia possibile
raccoglierlo con le tecniche elencate nella tabella
precedente esso deve:
a) essere sessualmente maturo, cioè
avere raggiunto l’età della maturazione sessuale e
b) essere in estro, cioè trovarsi
in quella condizione biologica, legata strettamente
al fotoperiodo, nella quale i suoi testicoli, sotto
stimoli ormonali (a loro volta originatisi da
stimoli fotoperiodici ed etologici) producono
cellule spermatiche che sempre sotto effetto degli
ormoni sessuali, maturano, in vari stadi, in
spermatozoi.
Ora, se questo maschio viene tenuto
in una normale voliera e se questa voliera è
costruita adeguatamente, lo stimolo fotoperiodico
non mancherà. Il problema è lo stimolo etologico,
che non mancherà solo nel caso in cui il maschio sia
imprintato sull’uomo e quindi metta in pratica le
sue parate nuziali con l’allevatore. Ma se da questo
maschio si intende prelevare sperma con la tecnica
del massaggio, esso non può essere tenuto da solo in
voliera. Deve bensì essere tenuto in una voliera con
all’interno anche una femmina, nella speranza che,
se anche mancassero i comportamenti corteggiativi (o
non venissero corrisposti dalla femmina) il maschio
riesca ad avere un sufficiente stimolo etologico per
potere produrre spermatozoi maturi. Questo appena
descritto è un concetto estremamente importante,
perché se il maschio non ha prodotto sperma, è
inutile continuare ad insistere con i massaggi nella
speranza che questo sperma venga eiaculato. Inoltre,
uno dei vantaggi dell’inseminazione artificiale, che
sarebbe quello di poter fecondare più uova di più
femmine con lo sperma di un solo maschio, si
annullerebbe anche perché, come abbiamo detto prima,
la quantità e qualità di sperma ottenuto dai maschi
con la tecnica del massaggio forzato non sono
adeguate alla fecondazione di più femmine.
Allo stesso modo, anche la femmina
deve essere sessualmente matura ed entrare nella
fase di estro. Per le femmine si può capire subito
se possano essere idonee alla gametizzazione
artificiale o meno, perché esse DEVONO deporre le
uova, anche in assenza del maschio. Una femmina che
depone uova (e spesso accade anche alle femmine
addestrate per falconeria che depongono le uova al
blocco o nella voliera di muta) sarà idonea alla
gametizzazione artificiale, altrimenti è inutile
anche provare (magari si può attendere l’anno
successivo).
A questo punto sorge un ulteriore
problema: abbiamo un buon maschio che produce sperma
e ci permette di prelevarlo, e abbiamo una buona
femmina che depone uova (chiare, per ora,
ovviamente). Sembra facile allora: prendiamo il
spermae nella massima igiene e con una adeguata
tecnica lo inseriamo nell’ovidutto della femmina. Ma
quando vogliamo, nella realtà, procedere con questa
operazione vedremo che i problemi sono dietro la
porta. Lo sperma non può essere conservato per molto
tempo (vedi dopo) e mantiene la sua vitalità solo
nei primi minuti in seguito al prelievo. Più ore lo
conserviamo e più esso perderà le sue capacità di
fecondare un uovo. Il fatto è che non sempre è
possibile operare in maniera così lineare, perché se
possiamo prelevare dal maschio lo sperma solo poche
volte al giorno (di solito una) ma possiamo
scegliere noi a che ora, invece per gametizzare la
femmina dobbiamo operare entro un certo arco di
tempo che in un certo senso è determinato dalla
femmina stessa. La femmina infatti potrà essere
gametizzata solo entro e non più tardi di 4 ore dopo
la deposizione dell’ultimo uovo. Partendo
dall’inizio, allora, perdiamo il primo uovo che essa
depone, a questo punto entro al massimo le 4 ore
bisogna procedere a gametizzare la femmina.
Nell’arco di queste sei ore allora bisogna prelevare
lo sperma dal maschio. Ma operando così si corrono
dei rischi. Molto spesso accade che l’uovo venga
deposto durante la notte, e allora, a parte il fatto
che spesso ci si accorge solo in mattinata della
deposizione avvenuta, comunque se l’uovo viene
deposto, poniamo, alle 23:30 noi non possiamo
entrare di notte nella voliera del maschio e tentare
di prelevare lo sperma. In questo caso bisognerebbe
avere sempre pronta nel frigorifero una dose di
sperma prelevata nel tardo pomeriggio del giorno
prima, da usare in una eventualità del genere.
Bisogna, inoltre, alzarsi durante la nottata almeno
una volta per controllare l’eventuale deposizione di
un nuovo uovo. Si sono spesso avuti dei casi di
gametizzazione della femmina anche fino a 12 o più
ore dopo la deposizione dell’ultimo uovo, ma con
tale procedura si rischia o di rompere l’uovo quasi
maturo che si trova sull’ovidutto (che è un problema
molto grave perché può portare a peritoniti ed altri
danni non da poco) oppure di “saltare” l’uovo per
cui il successivo uovo non sarà fecondato e lo sarà
invece quello deposto ancora dopo.
Bibliografia
1. Anonymous. 1972. Artificial
insemination of raptors. Raptor Research 6:132.
2. Bercovitz, A.B., J. Collins,
P. Price and D. Tuttle. 1982. Noninvasive assessment
of seasonal hormone profile in captive bald eagles (Haliaeetus
leucocephalus). Zoo Biology 1:111-117.
3. Berry, R.B. 1971. B.P.I.E.
No. 18. Peregrine Falcons. Raptor Research News
5:15-16.
4. Berry, R.B. 1972.
Reproduction by artificial insemination in captive
American goshawks. Journal of Wildlife Management
36:1283-1288.
5. Berry, R.B. 1972. Special
conference on captivity breeding of raptors--a
report. Part F. Artificial insemination (Panel 7).
Raptor Research 6:F89-F110.
6. Bird, D.M. 1983. Evaluation
of the American kestrel (Falco sparverius) as a
laboratory research animal. 8th ICLAS/CALAS Symp.,
Vancouver. pp 3-9.
7. Bird, D.M. 1993. Abstract:
American kestrels at McGill University: the first
twenty years. Journal of Raptor Research 27:64. (Abstr.
presentation, annu. meet. Raptor Research Foundation,
Inc., Bellevue, Washington, 11-15 November, 1992)
8. Bird, D.M. and P.C. Lague.
1976. Management practices for captive Kestrels used
as semen donors for artificial insemination. Raptor
Research 10:92-96.
9. Bird, D.M., P.C. Lague and
R.B. Buckland. 1975. ABSTRACT: Artificial
insemination of American kestrels, p. 13. . Raptor
Research Foundation Fall Meeting-1975. RRF, Boise,
Idaho, Nov 21-25. (#13)
10. Bird, D.M., P.C. Lague and R.B.
Buckland. 1976. Artificial insemination vs. natural
mating in captive American kestrels. Canadian
Journal of Zoology 54:1183-1191.
11. Boyd, L.L., N.S. Boyd and F.C.
Dobler. 1977. Reproduction of prairie falcons by
artificial insemination. Journal of Wildlife
Management 41:266-271.
12. Brock, M.D., D.M. Bird and G.A.
Ansah. 1983. Cryogenic preservation of spermatozoa
of the American kestrel. International Zoo Yearbook
23:67-71.
13. Brock, M.K. and D.M. Bird. 1991.
Prefreeze and postthaw effects of glycerol and
dimethylacetamide on motility and fertilizing
ability of American kestrel (Falco sparverius)
spermatozoa. Journal of Zoo and Wildlife Medicine
22:453-459.
14. Burnham, W. 1992. Peregrine Fund,
Inc.: operation report 1992. Unpubl. rep., World
Center for Birds of Prey, Boise, Idaho. 231pp.
15. Burnham, W., P. Burnham, B.
Heinrich and P. Whitfield. 1989. Peregrine Fund Inc.,
Operation Report, 1989. Unpubl. Rep. World Center
for Birds of Prey, Boise, Idaho. 233.
16. Burnham, W.A. 1980. Peregrine
Fund's Western Operation Report, 1980. Unpubl. Rep.
Fort Collins, Colorado. 88 Pp.
17. Burnham, W.A.E. 1991. Peregrine
Fund, Inc. Operation report 1991. Unpubl. Rep.
Peregrine Fund, Inc., Boise, Idaho. 246 Pp..
18. Burnham, W.E., P. Burnham, B.
Heinrich and P. Whitfield. 1988. Operational Report,
1988. ed. The Peregrine Fund, Inc., Boise, Idaho, .
19. Cade, T.J. 1972. Some highlights
from captive breeding projects in 1972. Hawk Chalk
11:45-46.
20. Cade, T.J. 1980. The husbandry
of falcons for return to the wild. International Zoo
Yearbook 20:23-35.
21. Cade, T.J. and J.D. Weaver.
1976. Gyrfalcon X peregrine hybrids produced by
artificial insemination. NAFA 15:42-47.
22. Cade, T.J. and R.W. Fyfe. 1978.
What makes peregrine falcons breed in captivity?,
pp. 251-262. In S.A. Temple [ed.] . Endangered birds:
Management techniques for preserving threatened
species. University of Wisconsin Press, Madison, WI,
Proceedings of the Symposium on Management
Techniques for Preserving Endangered Birds,
University of Wisconsin, Madison, 1977.
23. Cade, T.J., J.D. Weaver, J.B.
Platt and W.A. Burnham. 1977. Propagation of large
falcons in captivity. Raptor Research 11:28-48.
24. Campbell, J.A. 1972. B.P.I.E.
No. 47. Red-tailed Hawks. 4 pp..
25. Canadian Wildlife Service. 1972.
B.P.I.E. No. 88. Prairie Falcons. 2 pp..
26. Canadian Wildlife Service. 1972.
B.P.I.E. No. 89. Peregrine Falcons. 2 pp..
27. Canadian Wildlife Service. 1974.
B.P.I.E. No. 118. Peregrine Falcons. 3 pp..
28. Canadian Wildlife Service. 1974.
B.P.I.E. No. 119. Peregrine Falcons. 4 pp..
29. Canadian Wildlife Service. 1974.
B.P.I.E. No. 120. Peregrine Falcons. 4 pp..
30. Canadian Wildlife Service. 1974.
B.P.I.E. No. 121. Peregrine Falcons. 3 pp..
31. Canadian Wildlife Service. 1974.
B.P.I.E. No. 122. Peregrine Falcons. 3 pp..
32. Canadian Wildlife Service. 1974.
B.P.I.E. No. 123. Gyrfalcons. 3 pp..
33. Canadian Wildlife Service. 1974.
B.P.I.E. No. 124. Peregrine Falcons. 3 pp..
34. Carpenter, J.W., R.R. Gabel,
S.N. Wiemeyer, W.C. Crawford JR, T.J. Cade, W.A.
Burnham, J.D. Weaver and D.M. Bird. 1987. Captive
breeding, eagles, hawks and harriers, large falcons,
small falcons, pp. 349-371. In B.G. Pendleton, B.A.
Millsap, K.W. Cline and D.M. Bird [eds.] . Raptor
management techniques manual. National Wildlife
Federation, Washington, D.C., National Wildlife
Federation Scientific and Technical Series No. 10.
35. Enderson, J.H. 1974. B.P.I.E.
No. 111. Peregrine Falcons. 4 pp..
36. Enderson, J.H. 1974. B.P.I.E.
No. 112. Peregrine Falcons. 4 pp..
37. Enderson, J.H., C.M. White and
U. Banasch. 1995. Captive breeding and releases of
peregrines Falco peregrinus in North America, pp.
437-444. In R.D. Chancellor, B.-U. Meyburg and J.J.
Ferrero [eds.] . Holarctic birds of prey;
proceedings of an international conference, Badajoz,
Spain, 17-22 April, 1995. WWG, Berlin, Germany, .
38. Fyfe, R.W. 1973. B.P.I.E. No.
81. Prairie Falcons. 2 pp..
39. Fyfe, R.W. 1973. B.P.I.E. No.
82. Peregrine Falcons. 2 pp..
40. Gee, G.F., C.A. Morrell, J.C.
Franson and O.H. Pattee. 1993. Cryopreservation of
American kestrel semen with dimethylsulfoxide.
Journal of Raptor Research 27:21-25.
41. Gerrard, J. 1976. Synopsis of
paper session, pp. 82-83. In T.N. Ingram [ed.] .
Save the eagle in '76: Proceedings of Bald Eagle
Days 1976. Eagle Valley Environmentalists, Inc.,
Apple River, Illinois, .
42. Gerriets, D. 1978. Artificial
insemination in peregrine falcons. In: Bird of prey
management techniques. T.A. Geer, ed. British
Falconers' Club. pp 93-97. (Paper presented at conf.
on Bird of Prey Management Techniques, Wadham
College, Oxford, Oct. 1977.)
43. Grier, J.W. 1972. Artificial
insemination and incubation with golden eagles.
Summary Report Unpublished.
44. Grier, J.W. 1972. Artificial
insemination produced baby golden eagles at Cornell
and lends new hope for endangered birdlife. National
Wildlife 10:44-45.
45. Grier, J.W. 1973. Techniques and
results of artificial insemination with golden
eagles. Raptor Research 7:1-12.
46. Grier, J.W. 1976. Techniques and
results of artificial insemination with golden
eagles, pp. 108-117. In T.N. Ingram [ed.] . Save the
eagle in '76: Proceedings of Bald Eagle Days 1976.
Eagle Valley Environmentalists, Inc., Apple River,
Illinois, .
47. Hamerstrom, F. 1968. B.P.I.E.
No. 5. Golden eagle artificial insemination. 4pp.
48. Hamerstrom, F. 1971. Semen
extender for artificial insemination. Raptor
Research News 5:91.
49. Hartley, R. 1993. Breeding the
African peregrine in captivity. Summary rep.,
1978-92, Zimbabwe Falconers' Club - Dep. of Nat.
Parks and Wildl. Management Joint Project. 32pp.
50. Hoolihan, J. and W. Burnham.
1985. Peregrine Falcon semen: a quantitive and
qualitative examination. Raptor Research 19:125-127.
51. Hunter, D.V., Jr. 1972. B.P.I.E.
No. 69. Red-tailed Hawks. 1 p..
52. Jackson, D.D. 1977. Fighting
beak and claw. Sports Illustrated :78-82, 84, 86,
88, 90, 92.
53. Nelson, R.W. 1975. Ethology
Information Exchange No. 3. 20 pp..
54. Nelson, R.W. and J.A. Campbell.
1974. 1974 breeding and behavior of captive arctic
peregrines. Hawk Chalk 13:44-61.
55. Parks, J.E. and V. Hardaswick.
1987. Fertility and hachability of falcon eggs after
insemination with frozen Peregrine Falcon semen.
Journal of Raptor Research 21:70-72.
56. Parks, J.E., W.R. Heck and V.
Hardaswick. 1986. Cryopreservation of peregrine
falcon semen and post-thaw dialysis to remove
glycerol. Raptor Research 20:15-20.
57. Pavlík, I., J. Cernik, J. Bárta,
J. Kundera and Z. Pecka. 1998. Occurrence of
coccidia (Caryospora neofalconis and Caryospora
kutzeri) in birds of prey in falcon breeding
facility in Milotice in the Czech Republic.
Veterinary Medicine - Czech 43:301-306.
58. Ruos, J.L. 1978. Raptor
hybridization--a review of the occurence,
significance, and regulation of activities permitted
under special purpose permit. Unpubl. rep. U.S. Fish
and Wildlife Service, Washington D.C. 12pp.
59. Schulz, R. 1981. Remarks on
artificial insemination on goshawks, pp. 189-190. In
R.E. Kenward and I.M. Lindsay [eds.] . Understanding
the goshawk. International Association for Falconry
and Conservation of Birds of Prey, Oxford, U.K., .
60. Temple, S.A. 1972. Artificial
insemination with imprinted birds of prey. Nature
237:287-288.
61. Wiemeyer, S.N. 1981. Captive
propagation of bald eagles at Patuxent Wildlife
Research Center and introductions into the wild,
1976-80. Raptor Research 15:68-82.
62. Wisniewski, G. 1995. Programme
for the reinstatement of the peregrine falcon Falco
peregrinus peregrinus in Poland. Acta Ornithologica
30:74-78.
Volete
Approfondire questo argomento?
Se volete
imparare di più le tecniche e approfondire i
concetti di questa pagina web,
consultate i
nostri prodotti multimediali, libri e CD
|